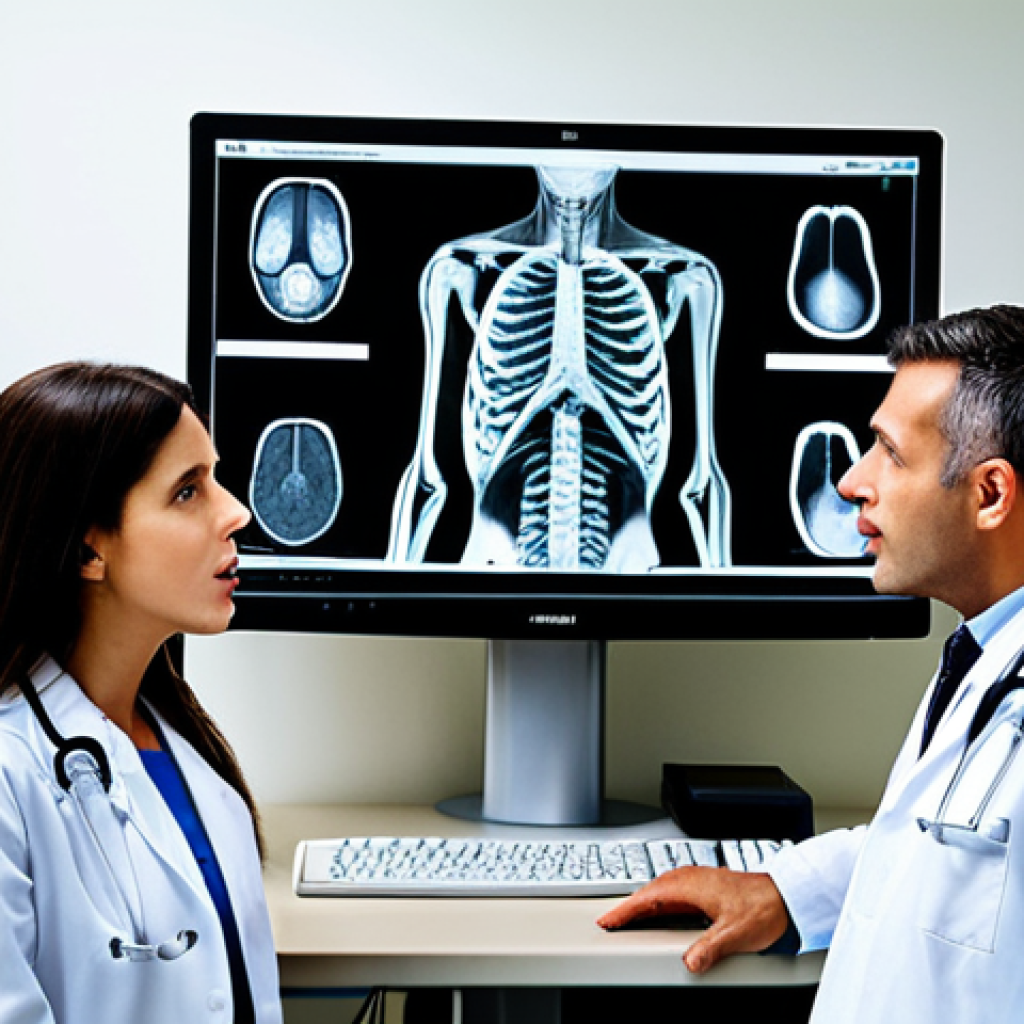
Il mondo della biotecnologia e della ricerca clinica sta vivendo una vera e propria rivoluzione. Nuove tecnologie, come l’intelligenza artificiale e la genomica, stanno aprendo orizzonti impensabili fino a poco tempo fa.
Pensiamo solo alla possibilità di sviluppare terapie personalizzate, mirate al DNA di ogni singolo paziente. Un cambiamento radicale che promette di migliorare la qualità della vita e allungare le aspettative di vita in modo significativo.
Ho seguito da vicino l’evoluzione di questi campi, e devo dire che sono rimasto sbalordito dalla velocità con cui le scoperte si susseguono. Approfondiamo insieme questo affascinante argomento nell’articolo che segue.
L’Intelligenza Artificiale al Servizio della Diagnosi: Un Nuovo Orizzonte

L’intelligenza artificiale (AI) sta rivoluzionando la diagnosi medica, offrendo strumenti potenti per analizzare dati complessi e identificare pattern che sfuggirebbero all’occhio umano.
Immaginate un software in grado di analizzare migliaia di immagini radiologiche in pochi secondi, individuando anomalie minime che potrebbero essere indicative di un tumore in fase iniziale.
Ho visto personalmente come questi sistemi AI abbiano accelerato i tempi di diagnosi e migliorato l’accuratezza, portando a trattamenti più tempestivi e efficaci.
1. Algoritmi Predittivi e Medicina Personalizzata
L’AI non si limita a supportare la diagnosi, ma può anche predire il rischio di sviluppare determinate patologie, consentendo interventi preventivi. Ricordo un progetto in cui un algoritmo predittivo, basato sull’analisi di dati genetici e clinici, era in grado di identificare i pazienti con un alto rischio di sviluppare malattie cardiovascolari.
Grazie a questa informazione, i medici potevano intervenire con modifiche dello stile di vita e terapie mirate, riducendo significativamente il rischio di eventi avversi.
2. Il Ruolo del Machine Learning nell’Analisi dei Dati Clinici
Il machine learning, una branca dell’AI, è particolarmente efficace nell’analisi di grandi quantità di dati clinici. Immaginate di poter analizzare i dati di migliaia di pazienti affetti da una determinata malattia, identificando i fattori che influenzano la risposta al trattamento.
Questo tipo di analisi può portare allo sviluppo di terapie personalizzate, mirate alle caratteristiche specifiche di ogni paziente.
3. Sfide Etiche e Regolatorie nell’Implementazione dell’AI
L’implementazione dell’AI nella diagnosi medica solleva anche importanti questioni etiche e regolatorie. Chi è responsabile in caso di errore diagnostico?
Come proteggere la privacy dei dati dei pazienti? Queste sono solo alcune delle domande che devono essere affrontate per garantire un utilizzo responsabile e sicuro dell’AI in ambito sanitario.
Personalmente, credo che sia fondamentale stabilire linee guida chiare e trasparenti per l’utilizzo dell’AI, coinvolgendo esperti di etica, giuristi e rappresentanti dei pazienti.
La Genomica e la Rivoluzione delle Terapie Personalizzate
La genomica, lo studio del genoma, sta aprendo nuove frontiere nella medicina personalizzata. Conoscere il profilo genetico di un paziente permette di sviluppare terapie mirate, più efficaci e con meno effetti collaterali.
Ho assistito a casi in cui pazienti affetti da tumori rari, per i quali non esistevano terapie standard, hanno beneficiato enormemente di trattamenti basati sull’analisi del loro genoma.
1. Il Sequenziamento del DNA e la Scoperta di Nuovi Biomarcatori
Il sequenziamento del DNA è diventato uno strumento fondamentale per la scoperta di nuovi biomarcatori, ovvero indicatori biologici che possono essere utilizzati per diagnosticare una malattia, predire la risposta al trattamento o monitorare la progressione della malattia.
Ricordo un progetto in cui, grazie al sequenziamento del DNA, è stato possibile identificare un nuovo biomarcatore per un tipo di leucemia, permettendo di sviluppare un test diagnostico più accurato e un trattamento più mirato.
2. Terapie Geniche e l’Editing del Genoma con CRISPR
Le terapie geniche e l’editing del genoma con CRISPR rappresentano un’altra frontiera della medicina personalizzata. Le terapie geniche consistono nell’inserire geni correttivi nelle cellule del paziente per curare malattie genetiche.
L’editing del genoma con CRISPR, invece, permette di modificare il DNA in modo preciso e mirato, aprendo nuove possibilità per la cura di malattie genetiche e acquisite.
3. Il Costo del Sequenziamento del Genoma e l’Accessibilità alle Terapie Personalizzate
Il costo del sequenziamento del genoma e l’accessibilità alle terapie personalizzate rappresentano ancora una sfida importante. Il sequenziamento del genoma è diventato più accessibile negli ultimi anni, ma rimane comunque costoso.
Inoltre, le terapie personalizzate, spesso basate su farmaci innovativi, possono essere molto costose, limitando l’accesso a molti pazienti. È fondamentale trovare soluzioni per rendere queste tecnologie più accessibili, garantendo che tutti i pazienti possano beneficiare dei progressi della genomica.
Ricerca Clinica: Nuovi Protocolli e Studi Innovativi
La ricerca clinica è fondamentale per lo sviluppo di nuove terapie e protocolli di trattamento. Negli ultimi anni, ho notato un aumento significativo degli studi clinici innovativi, che utilizzano nuove tecnologie e approcci terapeutici.
Penso, ad esempio, agli studi sull’immunoterapia, che mira a potenziare il sistema immunitario del paziente per combattere il cancro, o agli studi sulle terapie cellulari, che utilizzano cellule ingegnerizzate per curare malattie autoimmuni.
1. Studi Randomizzati Controllati e l’Importanza del Gruppo di Controllo
Gli studi randomizzati controllati (RCT) sono considerati il gold standard della ricerca clinica. In un RCT, i pazienti vengono assegnati casualmente a un gruppo di trattamento o a un gruppo di controllo.
Il gruppo di trattamento riceve la nuova terapia, mentre il gruppo di controllo riceve il trattamento standard o un placebo. L’importanza del gruppo di controllo risiede nel fatto che permette di confrontare l’efficacia della nuova terapia con quella del trattamento standard o del placebo, eliminando il rischio di bias.
2. Studi Osservazionali e l’Analisi dei Dati del Mondo Reale
Gli studi osservazionali, invece, non prevedono l’assegnazione casuale dei pazienti a un gruppo di trattamento o a un gruppo di controllo. Gli studi osservazionali possono essere utili per analizzare i dati del mondo reale, ovvero i dati raccolti nella pratica clinica quotidiana.
Questi dati possono fornire informazioni preziose sull’efficacia e la sicurezza delle terapie, nonché sui fattori che influenzano la risposta al trattamento.
3. Il Coinvolgimento dei Pazienti nella Ricerca Clinica
Il coinvolgimento dei pazienti nella ricerca clinica è sempre più importante. I pazienti possono fornire informazioni preziose sulle loro esperienze, preferenze e bisogni.
Questo tipo di informazione può aiutare i ricercatori a progettare studi clinici più rilevanti e a sviluppare terapie più efficaci. Credo che sia fondamentale coinvolgere i pazienti in tutte le fasi della ricerca clinica, dalla definizione degli obiettivi dello studio alla disseminazione dei risultati.
Le Biotecnologie e la Produzione di Farmaci Innovativi
Le biotecnologie stanno giocando un ruolo sempre più importante nella produzione di farmaci innovativi. Grazie alle biotecnologie, è possibile produrre farmaci biologici, come anticorpi monoclonali, proteine ricombinanti e vaccini, che sono più efficaci e con meno effetti collaterali rispetto ai farmaci tradizionali.
Ho visitato diverse aziende biotecnologiche e sono rimasto impressionato dalla complessità e dalla precisione dei processi produttivi.
1. Ingegneria Genetica e la Produzione di Proteine Ricombinanti
L’ingegneria genetica è una tecnica fondamentale per la produzione di proteine ricombinanti. L’ingegneria genetica consiste nell’inserire il gene che codifica per la proteina desiderata in un organismo ospite, come un batterio o una cellula di mammifero.
L’organismo ospite produce la proteina ricombinante, che viene poi purificata e utilizzata per la produzione di farmaci.
2. Colture Cellulari e la Produzione di Anticorpi Monoclonali
Le colture cellulari sono utilizzate per la produzione di anticorpi monoclonali. Gli anticorpi monoclonali sono proteine che si legano a un bersaglio specifico, come una proteina presente sulla superficie di una cellula tumorale.
Gli anticorpi monoclonali possono essere utilizzati per bloccare l’attività del bersaglio, per segnalare la cellula al sistema immunitario o per trasportare farmaci direttamente alla cellula.
3. Sfide nella Produzione di Farmaci Biologici
La produzione di farmaci biologici presenta diverse sfide. I farmaci biologici sono molecole complesse, che richiedono processi produttivi sofisticati e costosi.
Inoltre, i farmaci biologici sono più suscettibili alla degradazione rispetto ai farmaci tradizionali, richiedendo condizioni di conservazione e trasporto rigorose.
È fondamentale investire nella ricerca e nello sviluppo di nuove tecnologie per la produzione di farmaci biologici, al fine di ridurre i costi e migliorare la qualità dei farmaci.
L’Etica nella Biotecnologia e nella Ricerca Clinica
L’etica è un aspetto fondamentale nella biotecnologia e nella ricerca clinica. È fondamentale garantire che le nuove tecnologie e i nuovi trattamenti siano sviluppati e utilizzati in modo responsabile e sicuro, rispettando i diritti e la dignità dei pazienti.
Ho partecipato a diversi dibattiti sull’etica della biotecnologia e sono convinto che sia fondamentale coinvolgere esperti di etica, giuristi e rappresentanti dei pazienti nella definizione delle linee guida e delle normative.
1. Consenso Informato e la Protezione dei Dati Personali
Il consenso informato è un principio fondamentale dell’etica della ricerca clinica. Il consenso informato prevede che i pazienti siano informati in modo completo e comprensibile sui rischi e i benefici della partecipazione a uno studio clinico, e che abbiano la possibilità di accettare o rifiutare liberamente la partecipazione.
La protezione dei dati personali è un altro aspetto fondamentale dell’etica della ricerca clinica. È fondamentale garantire che i dati dei pazienti siano trattati in modo confidenziale e sicuro, nel rispetto della normativa sulla privacy.
2. Accesso Equo alle Nuove Tecnologie e ai Nuovi Trattamenti
L’accesso equo alle nuove tecnologie e ai nuovi trattamenti è un tema centrale dell’etica della biotecnologia. È fondamentale garantire che tutti i pazienti, indipendentemente dalla loro condizione economica o sociale, abbiano la possibilità di beneficiare dei progressi della scienza e della tecnologia.
Questo richiede un impegno da parte dei governi, delle aziende farmaceutiche e delle organizzazioni non profit per ridurre i costi dei farmaci e per sviluppare programmi di accesso che garantiscano che i farmaci siano disponibili per tutti i pazienti che ne hanno bisogno.
3. La Responsabilità Sociale della Biotecnologia
La biotecnologia ha un’enorme responsabilità sociale. Le aziende biotecnologiche hanno la responsabilità di sviluppare tecnologie e trattamenti che siano sicuri, efficaci e accessibili a tutti.
Inoltre, le aziende biotecnologiche hanno la responsabilità di contribuire alla soluzione dei problemi globali, come la fame, la povertà e le malattie infettive.
Credo che la biotecnologia abbia il potenziale per migliorare la vita di milioni di persone in tutto il mondo, ma è fondamentale che questo potenziale sia realizzato in modo responsabile e sostenibile.
| Area | Impatto | Sfide |
|---|---|---|
| Diagnostica | Migliore accuratezza, diagnosi precoce | Questioni etiche, privacy dei dati |
| Terapie Personalizzate | Trattamenti mirati, meno effetti collaterali | Costi elevati, accessibilità |
| Ricerca Clinica | Sviluppo di nuove terapie, miglioramento dei protocolli | Coinvolgimento dei pazienti, analisi dei dati |
| Produzione Farmaceutica | Farmaci biologici più efficaci | Complessità produttiva, conservazione |
Il Futuro della Biotecnologia e della Ricerca Clinica: Una Visione Ottimistica
Sono convinto che il futuro della biotecnologia e della ricerca clinica sia molto promettente. Le nuove tecnologie, come l’intelligenza artificiale, la genomica e la biologia sintetica, stanno aprendo nuove frontiere nella medicina e nella biologia.
Penso che nei prossimi anni vedremo progressi significativi nella cura del cancro, delle malattie genetiche e delle malattie infettive. Sono ottimista sul fatto che la biotecnologia e la ricerca clinica contribuiranno a migliorare la qualità della vita e ad allungare le aspettative di vita di milioni di persone in tutto il mondo.
1. Convergenza di Tecnologie e Approcci Multidisciplinari
Il futuro della biotecnologia e della ricerca clinica sarà caratterizzato dalla convergenza di tecnologie e approcci multidisciplinari. Vedremo una maggiore integrazione tra l’intelligenza artificiale, la genomica, la biologia sintetica e altre discipline scientifiche.
Questa convergenza porterà a nuove scoperte e a nuove terapie che non sarebbero state possibili con approcci tradizionali.
2. Medicina Predittiva e l’Importanza della Prevenzione
La medicina predittiva diventerà sempre più importante. Grazie all’analisi dei dati genetici e clinici, saremo in grado di predire il rischio di sviluppare determinate patologie e di intervenire con misure preventive.
La prevenzione diventerà un aspetto centrale della medicina, consentendo di ridurre il carico di malattie e di migliorare la salute pubblica.
3. Collaborazione Internazionale e la Condivisione dei Dati
La collaborazione internazionale e la condivisione dei dati saranno fondamentali per accelerare il progresso scientifico. La condivisione dei dati genetici, clinici e di ricerca tra i diversi paesi e le diverse istituzioni permetterà di accelerare la scoperta di nuovi biomarcatori, di nuove terapie e di nuove strategie di prevenzione.
Credo che sia fondamentale promuovere la collaborazione internazionale e la condivisione dei dati per affrontare le sfide globali della salute.
Considerazioni Finali
Il progresso nella biotecnologia e nella ricerca clinica promette di trasformare radicalmente la medicina, offrendo nuove speranze per la cura di malattie complesse. Affrontare le sfide etiche e garantire l’accesso equo a queste innovazioni saranno cruciali per realizzare appieno il loro potenziale. L’impegno continuo nella ricerca e nella collaborazione internazionale ci guiderà verso un futuro più sano e prospero. Speriamo che questo articolo abbia fornito una panoramica completa ed illuminante sulle frontiere della medicina moderna.
Informazioni Utili
1. Il sito del Ministero della Salute italiano offre informazioni aggiornate sulle politiche sanitarie e le innovazioni mediche.
2. L’Agenzia Italiana del Farmaco (AIFA) fornisce informazioni dettagliate sui farmaci disponibili in Italia e le loro normative.
3. Le associazioni di pazienti offrono supporto e informazioni utili per chi affronta determinate patologie.
4. Le università e i centri di ricerca italiani sono all’avanguardia nella ricerca biomedica e offrono opportunità di partecipazione a studi clinici.
5. I portali di informazione medica online, come “Doctor’s Life”, forniscono aggiornamenti sulle ultime scoperte scientifiche e le nuove terapie.
Punti Chiave
L’intelligenza artificiale sta migliorando l’accuratezza delle diagnosi mediche.
La genomica permette terapie personalizzate basate sul profilo genetico del paziente.
La ricerca clinica è fondamentale per lo sviluppo di nuovi trattamenti e protocolli.
Le biotecnologie producono farmaci biologici innovativi e più efficaci.
L’etica è essenziale per garantire un uso responsabile e sicuro delle nuove tecnologie.
Domande Frequenti (FAQ) 📖
D: Quali sono le implicazioni etiche delle terapie geniche personalizzate?
R: Le terapie geniche personalizzate sollevano diverse questioni etiche complesse. Innanzitutto, l’accesso a queste terapie innovative potrebbe non essere equo, creando disparità tra chi può permettersele e chi no.
Poi, c’è il rischio di “miglioramento” genetico, che potrebbe portare a una società in cui certe caratteristiche sono considerate superiori ad altre. Infine, la manipolazione del DNA solleva interrogativi sulla sicurezza a lungo termine e sugli effetti non intenzionali sulle generazioni future.
Ne ho parlato con un medico specializzato in bioetica, e mi ha spiegato che è fondamentale un dibattito pubblico ampio e trasparente per definire i limiti e le responsabilità di queste tecnologie.
Ricordo ancora quando mi disse: “Dobbiamo chiederci non solo se possiamo fare qualcosa, ma se dobbiamo farlo”.
D: In che modo l’intelligenza artificiale sta cambiando il processo di scoperta di nuovi farmaci?
R: L’intelligenza artificiale sta accelerando enormemente il processo di scoperta di nuovi farmaci. Tradizionalmente, questo processo era lungo e costoso, richiedendo anni di ricerca e sperimentazione.
L’IA può analizzare enormi quantità di dati, identificare potenziali bersagli farmacologici, prevedere l’efficacia di una molecola e ottimizzare la struttura dei farmaci.
Ho assistito a una presentazione di una startup italiana che usa l’IA per simulare l’interazione tra farmaci e proteine, riducendo drasticamente i tempi e i costi della ricerca.
Mi hanno mostrato come, grazie al loro algoritmo, riescono a scremare migliaia di molecole in pochi giorni, identificando quelle più promettenti. Un vero game-changer!
D: Quali sono le sfide principali per la diffusione su larga scala delle nuove tecnologie biotecnologiche?
R: Nonostante il grande potenziale, la diffusione su larga scala delle nuove tecnologie biotecnologiche si scontra con diverse sfide. Innanzitutto, i costi elevati di ricerca, sviluppo e produzione rendono difficile l’accesso a queste tecnologie per molti pazienti e sistemi sanitari.
Inoltre, la mancanza di infrastrutture adeguate e di personale specializzato in alcuni paesi può limitare l’implementazione di queste terapie innovative.
Infine, la complessità delle normative e la necessità di garantire la sicurezza e l’efficacia delle nuove tecnologie richiedono un approccio cauto e collaborativo tra ricercatori, aziende farmaceutiche e autorità regolatorie.
Ricordo di aver letto un articolo su “Il Sole 24 Ore” che evidenziava proprio come la lentezza burocratica e la frammentazione del sistema sanitario italiano rappresentino un freno all’adozione di queste nuove tecnologie, creando un divario tra l’innovazione e la sua effettiva applicazione.
📚 Riferimenti
Wikipedia Encyclopedia
구글 검색 결과
구글 검색 결과
구글 검색 결과
구글 검색 결과
구글 검색 결과